PRRs (engl. pattern-recognition receptors, dt. Mustererkennungsrezeptoren)
Als PRRs werden Proteine bezeichnet, welche es dem Wirt erlauben, Mikroben zu erkennen.
Funktionsprinzip ist die Unterscheidung von körpereigen und -fremd, wobei im Falle der PRRs konservierte Strukturen der Mikroben als fremd erkannt werden. Dies können z.B. Nukleinsäuren, Zellwandbestandteile und Flagellen sein. Diese Stoffe werden allgemein auch als MAMPs (microbe-associated molecular patterns) bezeichnet. Die Fähigkeit zur Erkennung von MAMPs durch Körperzellen wird als angeborene Immunität bezeichnet. Diese Reaktion führt zur Freisetzung von Mediatoren (Zytokinen, Chemokinen, anti-mikrobiellen Peptiden, u.a.), welche Zellen des adaptiven Immunsystems aktivieren und rekrutieren bzw. direkt Pathogene inaktivieren können. PRRs sind in fast allen Körperzellen vorhanden und erlauben es diesen "zellautonom" auf Pathogene zu reagieren, ohne dass hierfür Zellen des Immunsystems notwendig sind. Letztlich ist jedoch eine Aktivierung von Mustererkennungsrezeptoren fundamental für die Induktion von adaptiven Immunantworten.
Das Konzept beruht auf dem Postulat von Charles Janeway der 1989 erkannte, dass für die Induktion von adaptiven Immunantworten ein initialer Auslöser durch die angeborene Immunantwort notwendig ist. Dies ist z.B. der Grund, weshalb bei den meisten Impfungen sog. Adjuvantien zur Induktion einer Immunantwort verabreicht werden müssen.
Prominentes Beispiel für ein MAMP ist das bakterielle Lipopolysaccarid (LPS), auch als Endotoxin bezeichnet. Dieser in den Zellwänden von Gram negativen Bakterien vorkommende Stoff wird von den PRRs TLR4 und einem intrazellulärer Rezeptor erkannt. Dieser Prozess ist grundlegend für die Entstehung der lebendbedrohlichen Sepsis, einer überschießenden Aktivierung des Immunsystems. 2011 wurde der Nobelpreis an Jules Hoffmann und Bruce Beutler für ihre Arbeiten zur Charakterisierung des Toll Rezeptors in Drosophila und des Toll-like receptors TLR4 Proteins in der Maus bei Immunantworten verliehen.
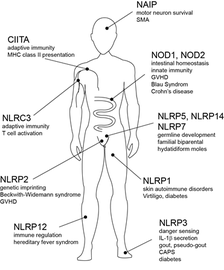
Neben den TLRs, welche MAMPs im extrazellulären Lumen erkennen, existiert eine Reihe von PRRs im Zytosol von Körperzellen, welche inflammatorische Antworten auf eine Infektion mit Pathogenen vermitteln. Hier spielen neben Rezeptoren für virale Nukleinsäurestrukturen vor allem die Proteine der Familie der Nukleotide-Bindungsdomänen und Oligomerisationsdomänen Rezeptoren, oder NOD-ähnlichen Rezeptoren (NLR) eine wichtige Rolle. Von den 22 NLR Proteinen im Menschen ist vor allem die Rolle von NOD1 und NOD2 als Rezeptoren für Bestandteile der bakteriellen Zellwand (Peptidoglycan Fragmente) derzeit gut charakterisiert. Eine Vielzahl an Arbeiten zeigt, dass diese Proteine eine wichtige Rolle bei der Immunabwehr gegen eine Vielzahl Gram positiver und Gram negativer Bakterien spielen. Zudem sind diese Proteine an der Gewebe- und Immun-Homöostase insbesondere des intestinalen Systems beteiligt. Die wichtige Rolle des NOD2 Proteins im Menschen ist eindrucksvoll durch die Assoziation von erblichen inflammatorischen Erkrankungen mit Mutationen im NOD2 Gen belegt. So führen bestimmte Mutationen zu einer stark erhöhten Prädisposition für die schwere entzündliche Magen-Darmerkrankung Morbus Crohn, während für andere Mutationen in NOD2 ein kausaler Zusammenhang mit einer seltenen systemischen Entzündung (Blau-Syndrom) belegt ist. Eine wichtige physiologische Rolle ist auch für andere NLR Proteine gezeigt worden. Mutationen in einer Reihe von NLRs wurden mit teils schweren erblichen Erkrankungen assoziiert (siehe Abb. 1).
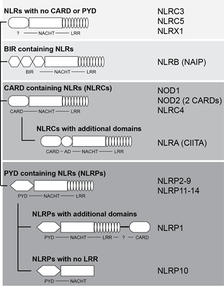
NLRs zeigen eine typischen dreigeteilten Domänenstruktur. Sie bestehen in den meisten Fällen aus einer N-terminalen „death domain fold“ Domäne (meist PYD oder CARD) einer zentralen, für diese Familie typischen, ATPase Domäne (NACHT Domäne) und C-Terminal gelegenen „leucine rich repeats“ (LRRs) (siehe Abb. 2).
Der derzeitige Stand der Forschung legt nahe, dass die Interaktion von MAMP über die LRRs vermittelt wird und eine Aktivierung des Rezeptors durch Oligomerisation über die NACHT Domäne bedingt, welche Interaktionen von Adaptoren und die Einleitung von Signaltransduktionsprozessen mit der N-terminalen Domäne erlauben.
Derzeit ist die Rolle vieler NLR Proteine des Menschen und der Maus noch nicht im Detail verstanden.
Die funktionelle Charakterisierung dieser Proteine wird uns helfen, die Funktionsweise des angeborenen Immunsystems besser zu verstehen und Ansatzpunkte für neue Therapien zur Behandlung entzündlicher Erkrankungen liefern.